Autore:
Charles Brown
Data Della Creazione:
2 Febbraio 2021
Data Di Aggiornamento:
28 Giugno 2024

Contenuto
- Al passo
- Metodo 1 di 3: legami ionici di base
- Metodo 2 di 3: metalli di transizione
- Metodo 3 di 3: legami con ioni poliatomici
- Suggerimenti
I legami ionici sono costituiti da cationi (ioni positivi) e anioni (ioni negativi). I legami ionici di solito sono costituiti da un metallo e uno o più non metalli. Per nominare un legame ionico, devi solo trovare il nome del catione e dell'anione presenti nel composto. Devi prima scrivere il nome del metallo, seguito dal nome del non metallo con il suo corrispondente nuovo finale. Se vuoi sapere come denominare i legami ionici in una varietà di situazioni, segui questi passaggi.
Al passo
Metodo 1 di 3: legami ionici di base
 Annota la formula del legame ionico. Diciamo il legame ionico su cui stai lavorando NaCl è.
Annota la formula del legame ionico. Diciamo il legame ionico su cui stai lavorando NaCl è.  Annota il nome del metallo o del catione. Questo è lo ione caricato positivamente nel legame ed è sempre scritto per primo in una formula di legame ionico. Dopo è il sodio. Quindi scrivi Sodio sopra.
Annota il nome del metallo o del catione. Questo è lo ione caricato positivamente nel legame ed è sempre scritto per primo in una formula di legame ionico. Dopo è il sodio. Quindi scrivi Sodio sopra.  Annota il nome del non-metallo, o anione, con la fine "-ide".Cl è il cloro (cloro). Per aggiungere il finale "ide", basta sostituire l'ultima sillaba "-ine" con "-ide". Diventa cloro cloruro.
Annota il nome del non-metallo, o anione, con la fine "-ide".Cl è il cloro (cloro). Per aggiungere il finale "ide", basta sostituire l'ultima sillaba "-ine" con "-ide". Diventa cloro cloruro.  Combina i nomi. NaCl può essere scritto come cloruro di sodio.
Combina i nomi. NaCl può essere scritto come cloruro di sodio.  Esercitati a denominare legami ionici semplici. Una volta che sei riuscito in questa formula, prova a nominare alcuni legami ionici più semplici. Anche memorizzarne alcuni può aiutarti a capire meglio come denominare i legami ionici. Eccone altri:
Esercitati a denominare legami ionici semplici. Una volta che sei riuscito in questa formula, prova a nominare alcuni legami ionici più semplici. Anche memorizzarne alcuni può aiutarti a capire meglio come denominare i legami ionici. Eccone altri: - Li2S = Solfuro di litio

- Ag2S = Solfuro d'argento

- MgCl2 = Cloruro di magnesio

- Li2S = Solfuro di litio
Metodo 2 di 3: metalli di transizione
 Annota la formula del legame ionico. I metalli di transizione possono essere trovati al centro della tavola periodica. Hanno preso il loro nome perché i loro numeri di ossidazione, o le loro cariche, cambiano costantemente. Diciamo che stai lavorando con questo legame: Fe2O3.
Annota la formula del legame ionico. I metalli di transizione possono essere trovati al centro della tavola periodica. Hanno preso il loro nome perché i loro numeri di ossidazione, o le loro cariche, cambiano costantemente. Diciamo che stai lavorando con questo legame: Fe2O3.  Annota la carica del metallo. Sai che il metallo avrà una carica positiva, quindi puoi ottenere il 3 di O3 cancellalo e scrivilo Fe ha una carica di +3. (Puoi, per divertimento, fare il contrario e scriverlo O ha una carica di -2.) A volte viene indicata la carica.
Annota la carica del metallo. Sai che il metallo avrà una carica positiva, quindi puoi ottenere il 3 di O3 cancellalo e scrivilo Fe ha una carica di +3. (Puoi, per divertimento, fare il contrario e scriverlo O ha una carica di -2.) A volte viene indicata la carica.  Annota il nome del metallo. Dal momento che lo sai Fe ferro e che ha una carica di +3, puoi farlo Ferro (III) menzionare. Ricorda di usare solo numeri romani quando scrivi il nome e non quando scrivi la formula.
Annota il nome del metallo. Dal momento che lo sai Fe ferro e che ha una carica di +3, puoi farlo Ferro (III) menzionare. Ricorda di usare solo numeri romani quando scrivi il nome e non quando scrivi la formula.  Annota il nome del non metallo. Dal momento che lo sai O sta per ossigeno, puoi aggiungere il finale "-ide" e chiamarlo "ossido".
Annota il nome del non metallo. Dal momento che lo sai O sta per ossigeno, puoi aggiungere il finale "-ide" e chiamarlo "ossido".  Unisci il nome e il secondo nome. Adesso ce l'hai. Fe2O3 = Ossido di ferro (III).
Unisci il nome e il secondo nome. Adesso ce l'hai. Fe2O3 = Ossido di ferro (III).  Usa il vecchio metodo di denominazione. Nel vecchio metodo di denominazione, che è anche usato, si usano i nomi "ferro" e "ferrico" per i metalli, invece dei numeri romani. Se lo ione metallico ha uno stato di ossidazione inferiore (una carica numerica inferiore, ignorando il "+" o "-"), utilizzare "ferroso". Se ha una carica maggiore si usa "ferri". Fe ha lo stato inferiore (Fe ha lo stato superiore), quindi diventa ferroso. Il nome di FeO può anche essere scritto come ferroossido.
Usa il vecchio metodo di denominazione. Nel vecchio metodo di denominazione, che è anche usato, si usano i nomi "ferro" e "ferrico" per i metalli, invece dei numeri romani. Se lo ione metallico ha uno stato di ossidazione inferiore (una carica numerica inferiore, ignorando il "+" o "-"), utilizzare "ferroso". Se ha una carica maggiore si usa "ferri". Fe ha lo stato inferiore (Fe ha lo stato superiore), quindi diventa ferroso. Il nome di FeO può anche essere scritto come ferroossido. 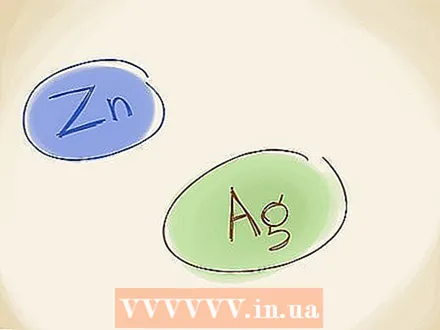 Ricorda le eccezioni. Esistono due metalli di transizione che non hanno una carica fissa. Questi sono zinco (Zn) e argento (Ag). Ciò significa che non è necessario utilizzare i numeri romani o il vecchio metodo di denominazione quando si descrivono questi elementi.
Ricorda le eccezioni. Esistono due metalli di transizione che non hanno una carica fissa. Questi sono zinco (Zn) e argento (Ag). Ciò significa che non è necessario utilizzare i numeri romani o il vecchio metodo di denominazione quando si descrivono questi elementi.
Metodo 3 di 3: legami con ioni poliatomici
 Annota la formula degli ioni poliatomici. Questo legame sarà composto da più di due ioni. Supponiamo che tu stia lavorando sul seguente legame: FeNH4(COSÌ4)2.
Annota la formula degli ioni poliatomici. Questo legame sarà composto da più di due ioni. Supponiamo che tu stia lavorando sul seguente legame: FeNH4(COSÌ4)2.  Trova la carica del metallo. Dovrai fare un po 'di matematica per trovarlo. Prima di tutto, sai che è solfato, o COSÌ4 ione, ha una carica di -2 e che ce ne sono due, a causa del 2 sotto la parentesi. Quindi, 2x -2 = -4. Allora sai che NH4, o lo ione ammoniaca, ha una carica di +1. Aggiungi -4 e 1 e ottieni -3. Ciò significa che lo ione ferro, Fe, deve avere una carica di +3 per equalizzarlo e rendere neutro il legame.
Trova la carica del metallo. Dovrai fare un po 'di matematica per trovarlo. Prima di tutto, sai che è solfato, o COSÌ4 ione, ha una carica di -2 e che ce ne sono due, a causa del 2 sotto la parentesi. Quindi, 2x -2 = -4. Allora sai che NH4, o lo ione ammoniaca, ha una carica di +1. Aggiungi -4 e 1 e ottieni -3. Ciò significa che lo ione ferro, Fe, deve avere una carica di +3 per equalizzarlo e rendere neutro il legame.  Annota il nome del metallo. In questo caso, puoi fare entrambe le cose Ferro (III) come ferri annotare.
Annota il nome del metallo. In questo caso, puoi fare entrambe le cose Ferro (III) come ferri annotare.  Annota il nome degli ioni non metallici. In questo caso usi ammonio e solfato, o solfato d'ammonio.
Annota il nome degli ioni non metallici. In questo caso usi ammonio e solfato, o solfato d'ammonio.  Combina il nome del metallo con i nomi dei non metalli. Puoi chiamare il legame FeNH4(COSÌ4)2 dare da o ferro (III) ammonio solfato o solfato ferrico di ammonio scrivere.
Combina il nome del metallo con i nomi dei non metalli. Puoi chiamare il legame FeNH4(COSÌ4)2 dare da o ferro (III) ammonio solfato o solfato ferrico di ammonio scrivere.
Suggerimenti
- Se vai nella direzione opposta e hai numeri romani, devi fare una "radiografia" della molecola. Il numero romano è l'accusa del catione.